Sprechen Sie mit einem Produktexperten*
Schreiben Sie uns eine E-Mail
Menü
Pharmabranche vor Veränderungen - Zuspitzung

Nicht nur die Digitalisierung verändert die Pharmabranche, auch eine neue Preispolitik in den USA und das „Pharma-Paket“ in Europa zwingen die Unternehmen zu einem flexibleren Handeln. Für Europas Pharmakonzerne ist das eine Chance.
„Und heute unterhalten wir uns über Bluthochdruck. Wussten Sie, dass allein Deutschland fast 30 Millionen Menschen an Hypertonie leiden?“ Der nette Herr auf dem Bildschirm schaut mich sehr ernst an. Er räuspert sich und rückt sein Stethoskop zurecht, das er leger und irgendwie aber auch professionell, zumindest so, wie man es sich als Laie bei einem Arzt vorstellt, um seinen Hals trägt. „Hypertonie, so der Fachausdruck für Bluthochdruck, betrifft uns alle,“ sagt er noch, und fast schon reflexartig fasse ich mir ans Herz. So, genug der Krankheiten, ich klicke weiter und lande bei einer netten Dame, die mir erzählt, dass alle auf dem Markt befindlichen Sonnencremes nicht mehr ausreichen, weil sie zu viel UV durchlassen und irgendeinen Schadstoff beinhalten, dessen Namen ich nicht verstanden habe. Die Lösung: eine neue Creme, ganz frisch aus amerikanischen Hightech-Labors.
Europas Pharmaindustrie muss fit werden. Es reicht! Jetzt sieht es verdammt nach Kommerz aus, das muss nicht sein. Doch die Grenzen zwischen Wissen und Aufklärung auf der einen Seite, Panikmache und Kommerz auf der anderen, sind meistens fließend, auch bei den Medfluencern.
Medfluencer, das sind Influencer, die nicht über Mode, Ernährung, Sport und sonst was „aufklären“, sondern eben über medizinische Themen im weitesten Sinne. Über 1.000 solche Medfluencer soll es allein hierzulande geben, sagen Beobachter. Einige von ihnen sind durchaus als Fachleute zu bezeichnen, Ärzte, Sanitäter und ähnliche Berufsgruppen, die sich wirklich mit der Materie „Gesundheit“ auskennen; andere sind wohl eher Fachleute auf dem Gebiet des Verkaufens. Und dennoch, Medfluencer können eine wichtige Funktion am Gesundheitsmarkt einnehmen, da sie auch zu komplexen medizinischen Problemen einen einfachen und schnellen Zugang bieten, und das in verständlicher Sprache. Etwa eben zum Thema Hypertonie, die von vielen Menschen wirklich unterschätzt wird, aber zu den häufigsten Todesursachen zählt. Medfluencer sind Teil einer modernen Gesundheitskommunikation, die sich mittlerweile häufig im digitalen Raum abspielt und damit auch charakteristisch für einen tiefgreifenden Wandel in der Medizin und in der Pharmabranche ist.
Das betrifft vor allem auch die europäische Pharmaindustrie. Die war lange Zeit weltweit federführend, hat ihre Position mittlerweile aber an die USA verloren. Und mit China steht ein neuer Forschungsgigant bereit. Auch wenn sich die pharmazeutischen Forschungs- und Entwicklungsausgaben im Vergleich zu Europa noch in Grenzen halten, Asien holt auf und könnte schon in einigen Jahren Europa übertrumpfen (siehe Grafik unten). Europas Pharmaindustrie muss fit für die Zukunft werden, sagen Experten.
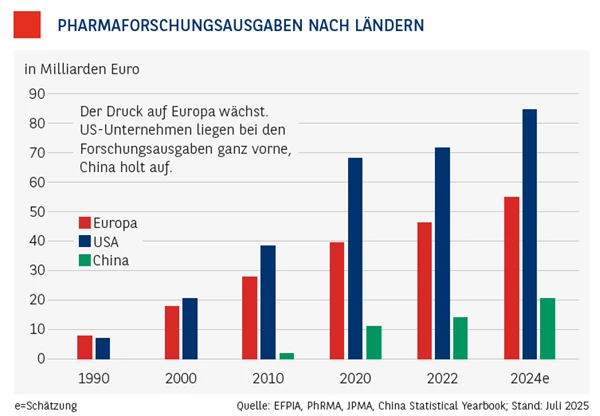
Die Pharmaunternehmen müssen umdenken. Doch wie soll das gehen? Die Pharmaindustrie steht ja ohnehin vor einem grundlegenden Wandel, nicht nur unter technologischen Gesichtspunkten. Das Digitalzeitalter verändert nämlich nicht nur die Kommunikation, es sorgt auch dafür, dass der medizinische Fortschritt deutlich schneller und effektiver wird, indem etwa riesige Datenmengen aus der Forschung zügig abgearbeitet werden können – Stichwort Big Data und Künstliche Intelligenz, beides Gebiete, auf denen die USA und China führend sind, nicht Europa.
Doch das ist nur die eine Seite, die die Pharmaindustrie zum Umdenken zwingt. Die andere Seite ist eher eine politische/gesellschaftliche, die mit der Ernennung von Donald Trump zum US-Präsidenten zwar nicht in die Welt kam, aber damit höchste Brisanz gewonnen hat. Diese Seite kulminiert in der Frage: Was dürfen Pharmaunternehmen? Hört sich im ersten Moment trivial an, ist es aber nicht. Dürfen Pharmaunternehmen etwa allein darüber entscheiden, welchen Preis sie für ein Medikament verlangen? In der Regel wird man mit „Ja“ antworten, es ist ja schließlich ihr Produkt, doch manchmal kann von einem Medikament Leben und Tod abhängen. Zolgensma ist so ein Medikament, dessen Einmaldosis über zwei Millionen Euro kostet. Kleine Kinder bekommen es, die unter spinaler Muskelatrophie leiden, einer Erbkrankheit, die zwar selten, aber immer wieder mal vorkommt und die unbehandelt meist tödlich endet. Bei einer solchen Notlage zwei Millionen Euro pro Dosis zu verlangen ist irgendwie nicht gerechtfertigt, oder doch?
Die nächsten Blockbuster
In den USA stehen im laufenden Jahr einige potenzielle Blockbuster zur Markteinführung bereit. Blockbuster sind Medikamente mit einem Jahresumsatz von einer Milliarde Dollar und mehr. Federführend bei Blockbustern sind amerikanische Unternehmen. Allein Vertex hält zwei potenzielle Blockbuster bereit. Aus Europa sind nur drei Unternehmen in der Liste vertreten – AstraZeneca, Sanofi und GSK –, aus Deutschland keins. Hier gibt es für die heimische Pharmaindustrie noch viel zu tun.

Hohe Ausgaben für Forschung und Entwicklung. Ob gerechtfertigt oder nicht, das können wir an dieser Stelle nicht beantworten, doch klar ist: Medikamentenpreise sind ein absolutes Politikum. Kaum eine andere Produktgruppe steht so im Fokus der Öffentlichkeit, kaum eine andere Ware ist so in ihrer Preisgestaltung umstritten und ein Stück weit auch undurchsichtig. Denn was ein Medikament am Ende in seiner Entwicklung einen Pharmakonzern wirklich kostet, ist nicht einfach so an einer Zahl abzulesen. Was nötig ist, um die Kosten zu decken, und was Gewinn ist, verschwimmt nicht selten ineinander. Da ist es kein Wunder, auch wenn völlig übertrieben und unbewiesen, dass immer wieder von der „Pharmalüge“ die Rede ist, von einer durch und durch korrupten Pharma-Industrie, die sich auf Kosten der Patienten die Taschen füllt.
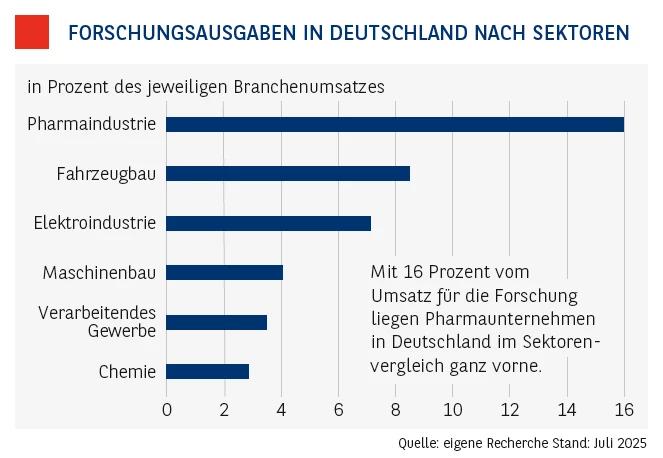
Doch zurück zu den Fakten. Tatsache ist, dass die Pharma-Industrie überdurchschnittlich viel Geld in Forschung und Entwicklung investiert. Derzeit werden etwa in Deutschland rund 16 Prozent des heimischen Pharma-Branchenumsatzes reinvestiert. Zum Vergleich: Im Fahrzeugbau sind es nur achteinhalb Prozent, also nur rund die Hälfte. Doch was kostet nun die Entwicklung eines neuen Medikaments? Studien kommen zu dem Ergebnis, dass sich die durchschnittlichen Kosten auf rund 2,2 Milliarden Euro belaufen. Angesichts dieser Ausgaben ist klar, dass Medikamente ihren Preis haben müssen, um die Kosten für die Entwicklung wieder einzuspielen. Darin enthalten, und das wird häufig unterschätzt, sind auch die Kosten für fehlgeschlagene Medikamentenentwicklungen. In der Pharma-Industrie spricht man hier auch von „versenkten Kosten“, also Ausgaben, die auf jeden Fall anfallen, egal was am Ende he-rauskommt. Stellt man in Rechnung, dass von rund 10.000 potenziellen Wirkstoffen in Schnitt am Ende nur einer übrig bleibt (siehe dazu Grafik oben), der zu einem Medikament verarbeitet wird, wird deutlich, dass die „versenkten Kosten“ einen enormen Anteil ausmachen und irgendwie refinanziert werden müssen. Auch das schlägt sich zum Schluss in den Medikamentenpreisen nieder.
Die Entwicklung neuer Medikamente ist komplex und langwierig. In der Regel schafft es von rund 10.000 Molekülen, die am Anfang als Wirkstoff in Frage kommen könnten, nach etwa 8 bis 12 Jahren nur durchschnittlich eine Substanz bis zur Zulassung. Die Zulassung bei der Europäischen Arzneimittelbehörde (EMA) dauert dann noch einmal rund eineinhalb Jahre, sodass am Ende nach etwa 13,5 Jahren und unzähligen Fehlschlägen ein fertiges Medikament steht. Das muss dann alle vorherigen Fehlschläge mitfinanzieren.
In den USA sind die Preise besonders hoch. Und dennoch bleiben Zweifel an der Preisgestaltung. Das sieht man nicht nur an der wachsenden Kritik aus den USA. Dort hat sich Präsident Donald Trump auf die Fahne geschrieben, die Arzneimittelpreise deutlich zu senken. Seine Kritik zielt dabei vor allem auf das unterschiedliche Preisniveau von Medikamenten in den verschiedenen Ländern ab. Denn die Medikamentenpreise spiegeln nicht eins zu eins die Entwicklungskosten plus Gewinnmargen der Unternehmen wider, sondern orientieren sich auch an der jeweiligen Kaufkraft der Einwohner eines Landes. Fast schon traditionell liegt diese in den USA besonders hoch, weswegen hier dann auch die höchsten Medikamentenpreise bezahlt werden müssen. Einem aktuellen Bericht des US-Thinktanks RAND zufolge sind die Preise in den USA durchschnittlich fast dreimal so hoch wie in anderen Ländern der OECD. Durch die höheren Kosten finanzieren die USA quasi die Entwicklungskosten, die anteilsmäßig von anderen, „ärmeren“, Ländern gezahlt werden müssten, mit. Deswegen Trumps unverhohlene Forderung: „Europa wird ein bisschen mehr zahlen, und Amerika etwas weniger.“

Die nächste Pandemie kommt bestimmt
Die Corona-Pandemie scheint überwunden, auch dank der Impfungen, die von der Pharmaindustrie in relativ kurzer Zeit entwickelt wurden. Doch nach der Pandemie ist vor der Pandemie, sagen Virologen. Denn Viren und andere Krankheitserreger entwickeln sich rasant weiter, mutieren und werden durch übermäßige Einnahme von Antibiotika resistent.
Anhand einer Liste der Weltgesundheitsorganisation (WHO), die verschiedene Viren und Krankheitserreger auflistet, wurden Experten nach ihrer Einschätzung gefragt, wer der Auslöser der nächsten Pandemie sein könnte. Ergebnis: 79 Prozent der für die Studie befragten Experten stuften Influenza-Viren als diejenigen Erreger ein, die am besorgniserregendsten sind. Mehr als 500 Millionen Menschen infizieren sich weltweit jedes Jahr mit dem Influenza-Virus. Zwischen 290.000 und 650.000 Personen sterben daran. Die Viren verbreiten sich durch Tröpfcheninfektion von Mensch zu Mensch, etwa beim Niesen, beim Husten oder auch beim Sprechen. „Jeden Winter haben wir eine Influenza-Saison. Man könnte sagen, dass es jeden Winter kleine Pandemien gibt“, erklärt Jon Salmanton-García von der medizinischen Fakultät am Universitätsklinikum Köln. „Diese kleinen Pandemien sind aber mehr oder weniger unter Kontrolle, da die verschiedenen Stämme nicht virulent genug sind, also nicht ansteckend genug.“
Doch das kann sich schnell ändern, wie ein Blick auf die Spanische Grippe in den Jahren 1918 und 1919 zeigt. Auslöser war damals das H1N1-Virus, das bis zu 50 Millionen Menschen das Leben kostete. Ebenfalls durch ein Influenza-Virus ausgelöst: die Hongkong-Grippe 1957 und 1958. Ihr fielen bis zu zwei Millionen Menschen zum Opfer.
Zu den Viren, die als potenzielle Pandemie-Auslöser gelten, gehört auch das Ebola-Virus. Entdeckt wurde es 1976. Seitdem hat es nahezu 30 pandemische Ausbrüche gegeben. Von 2014 bis 2016 herrschte die sogenannte Westafrika-Epidemie, der größte Ebola-Ausbruch in der Geschichte. Rund 28.600 Fälle wurden damals gemeldet. Die Zahl der Toten betrug mehr als 11.300. Betroffen waren Guinea, Liberia und Sierra Leone. Das Virus kann hämorrhagisches Fieber auslösen, und es kommt zu inneren und äußeren Blutungen. Nach Angaben der Bundeszentrale für gesundheitliche Aufklärung enden 30 bis 90 Prozent der Fälle tödlich.
Tiefgreifende Reform: das neue Pharma-Paket. Ob Trump am Ende mit seinen Bemühungen Erfolg hat und es zu einer Angleichung der Medikamentenpreise in den USA und Europa kommt, bleibt abzuwarten. Doch der Druck auf die europäische Pharmaindustrie wächst. Unterdessen hat Europa, hat die Europäische Union, quasi Gegenmaßnahmen ergriffen, die allerdings schon 2023 ins Leben gerufen wurden und keine direkte Reaktion auf Trumps Preissenkungsinitiative sind. Die Gegenmaßnahmen sind im sogenannten „Pharma-Paket“ gebündelt, das derzeit zwischen der Europäischen Kommission und dem Europäischen Parlament verhandelt wird. Es stellt in den Augen vieler Beobachter die tiefgreifendste Reform des europäischen Arzneimittelrechts seit 2004 dar und hat auch auf die heimische Pharmaindustrie unmittelbare Auswirkungen.
Die drei Kernstücke des Reformvorhabens sind: erstens eine bessere Versorgung der Einwohner der EU mit Medikamenten, durch die sichergestellt werden soll, dass in allen EU-Ländern alle zugelassenen Medikamente auch tatsächlich und zeitgleich verfügbar sind; zweitens eine schnelle und einfachere Entwicklung und Zulassung von Generika und Biosimilars, also von sogenannten Nachahmerpräparaten, die in der Regel billiger als die Originalarzneien sind (siehe dazu auch Seite 14); und drittens der Abbau regulatorischer Beschränkungen sowie ein schnelleres Zulassungsverfahren bei der Europäischen Arzneimittelbehörde EMA, die für die Genehmigung der Produkte verantwortlich ist.
Ein neues Anreizsystem – Europas Pharmaindustrie auf Fitnesskurs. Die drei Punkte lesen sich recht einfach, haben es aber in sich. Denn um etwa sicherzustellen, dass alle EU-Bürger möglichst zeitgleich an alle Medikamente kommen, die durch die EMA genehmigt wurden, wird ein Anreizsystem für die Pharmakonzerne eingeführt. Dieses funktioniert nach dem Prinzip, in je mehr Ländern der EU eine neue Arznei von einem Konzern zeitnah eingeführt wird, desto länger besteht der regulatorische Datenschutz (auf Englisch regulatory data protection, RDP). Dieser Schutz sorgte bislang dafür, dass die Pharmakonzerne nach der Zulassung eines Medikaments die Daten, die bei der Forschung zur Entwicklung des Präparats anfallen, acht Jahre lang nicht veröffentlichen mussten. Dadurch war es anderen Konzernen in der Regel nicht möglich, ähnliche Präparate zu entwickeln. Dieser Datenschutz entschädigt Pharmaunternehmen für die hohen Kosten der Zulassung, insbesondere klinischer Studien.
Das neue „Pharma-Paket“ sieht nun eine Verkürzung des Schutzes auf pauschal sechs Jahre vor, eröffnet aber gleichzeitig die Möglichkeit einer Verlängerung auf bis zu zwölf Jahre, wenn das betreffende Medikament in möglichst vielen oder sogar allen EU-Ländern eingeführt wird. Zudem kann das Pharmaunternehmen quasi „Schutz-Jahre“ einheimsen, etwa wenn es Medikamente entwickelt, die nur selten gebraucht werden, oder wenn es Forschungen auf Gebieten vorantreibt, die bislang vernachlässigt wurden.


Was sind eigentlich Generika und Biosimilars?
Generika und Biosimilars, im Deutschen auch als Nachahmerpräparate bezeichnet, kommen dann ins Spiel, wenn der Patentschutz auf Medikamente ausläuft. Dann dürfen die Originalpräparate nachgeahmt werden. Das übernehmen unter anderem die Generika-Hersteller, die sich auf das Kopieren spezialisiert haben. Auch die nachgeahmten Medikamente müssen die verschiedenen Testphasen durchlaufen und von den Zulassungsbehörden genehmigt werden. Doch die Kosten dafür sind sehr viel geringer als bei den Originalpräparaten, da die Wirkungs- und Funktionsweise der in den Präparaten enthaltenen Wirkstoffe bereits bekannt ist und nicht mehr nachgewiesen werden muss.
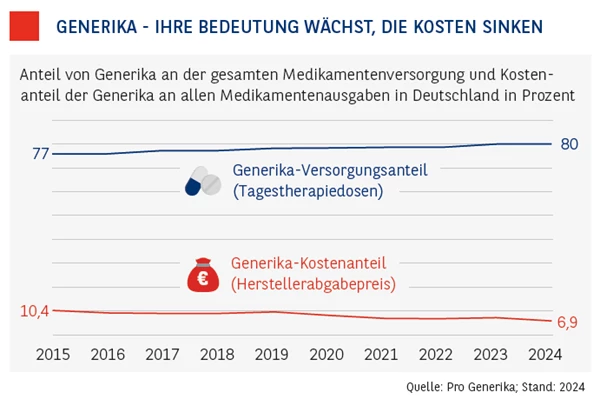
Generika können deshalb um bis zu 60 Prozent billiger am Markt angeboten werden als die Originalpräparate. Das hat dazu geführt, dass Generika einen stetig wachsenden Anteil am weltweiten Umsatz mit verschreibungspflichtigen Medikamenten verzeichnen. Das ist auch in Deutschland so. Rund 80 Prozent aller in Deutschland verschriebenen Medikamente sind mittlerweile Generika. Doch bei den Kosten machen sie nur rund 8 Prozent aller Medikamentenausgaben hierzulande aus.
Zur Kostenreduktion tragen vermehrt auch die sogenannten Biosimilars bei. Dabei handelt es sich um eine besondere Gruppe von Generika. Sie ahmen biotechnologisch hergestellte Medikamente nach. In diesem Bereich steht der Generika-Markt vor einer völlig neuen Entwicklung. Denn biotechnologisch hergestellte Medikamente gibt es erst seit Anfang der 1980er-Jahre. Da viele aber erst in den 1990er-Jahren entwickelt und später zugelassen wurden, laufen nun zahlreiche Patente aus. Sie zu kopieren ist oft nicht leicht. Sie sind im Gegensatz zu chemisch synthetisierten Arzneimitteln äußerst komplex aufgebaut und werden aus Mikroorganismen oder lebenden Zellen gewonnen. Von den Originalpräparaten können sie daher auch leicht abweichen, da Mikroorganismen und lebende Zellen stets eine gewisse Variabilität aufweisen.
Große Hersteller von Generika und Biosimilars in Europa sind unter anderem Sandoz aus der Schweiz und Merck KgaA aus Deutschland.
Schnellere Zulassung. Die Forschung, so Kritiker, wird durch das Pharma-Paket instrumentalisiert, um politische/gesellschaftliche Ziele zu erreichen. Ob das legitim ist oder nicht, ist umstritten. Aber auch der dritte Punkt – unter anderem ein schnelleres Zulassungsverfahren bei der Europäischen Arzneimittelbehörde EMA – hat es in sich. Die gesetzlich vorgesehene Dauer des Zulassungsverfahrens wird von 210 Tagen auf 180 Tage verkürzt. Im Schnitt brauchen die EMA und die EU-Kommission ohnehin deutlich länger, im zurückliegenden Jahr waren es von der Einreichung bei der EMA bis zur Zulassung durch die EU-Kommission 476 Tage. Mit der Kürzung orientiert man sich vor allem auch an der amerikanischen Zulassungsbehörde FDA, die im Schnitt 120 Tage weniger braucht.
Das führt auch dazu, dass in den USA deutlich mehr Medikamente zugelassen sind als in der EU. Ende 2024 waren es 101 Präparate, von denen immerhin 19 eine sehr hohe Versorgungsrelevanz aufweisen, weil sie unter anderem gegen Erkrankungen eingesetzt werden, gegen die es bislang keine Therapie gab. Im Extremfall kann das dazu führen, dass ein an einer bestimmten Krankheit leidender Patient in den USA behandelt, in der EU aber nicht beziehungsweise noch nicht therapiert werden kann.
Die Richtung stimmt. Verständlich, dass man nun in Europa alles versucht, um die Pharmabranche fit für die Zukunft zu machen. Das Pharma-Paket soll es richten – mehr Transparenz, mehr Agilität, mehr Wettbewerb. Flankiert wird das Paket von weiteren Maßnahmen. So plant die EU-Kommission, jährlich bis zu 10 Milliarden Euro in Biowissenschaften zu investieren. Bis 2030, so das Ziel, soll Europa zum weltweit wichtigsten Standort für die Biotechnologie werden.
Pharma-Paket, Life-Science-Strategie – die Richtung für die europäische Pharmabranche stimmt. Wie wichtig eine schlagkräftige und gut funktionierende medizinische Forschung ist, hat nicht zuletzt die Corona-Pandemie gezeigt. Auch dank Produkten deutscher Unternehmen ist es gelungen, die Pandemie zurückzudrängen. Und Corona war nicht erste und wird auch nicht die letzte Pandemie gewesen sein (siehe Seite 13).
Das alles zu erläutern und verständlich darzustellen wäre auch eine tolle Aufgabe für die Medfluencer, denke ich mir. Ich klicke noch mal rein und bekomme zu hören, dass „der nächste Lockdown unmittelbar bevorsteht“. Nun, so stelle ich mir das nicht vor. Also zurück zum Beitrag über die Hypertonie, von einem Facharzt erstellt, wie ich erfahre. Das gefällt mir schon besser. So macht das Sinn mit dem neuen Schwung für die europäische Pharmaindustrie.

Deals, Deals, Deals – Auf Einkaufstour in den USA
Im ersten Halbjahr wurden in der Pharmabranche einige sehr interessante Übernahmen getätigt, die einen Hinweis darauf geben, wie es im laufenden zweiten Halbjahr und auch 2026 weitergehen könnte. So hat der Schweizer Pharmakonzern Novartis das Unternehmen Regulus Therapeutics aus den USA übernommen. Regulus ist ein Biotech-Unternehmen, das RNA-basierte Therapien entwickelt. Die Grundidee von RNA-basierten Therapien ist die Annahme, dass durch spezifische Informationen, die man in Zellen eines Patienten einbringt, Krankheiten vorgebeugt oder der Krankheitsverlauf verändert werden kann. So entwickelte mRNA-Impfstoffe als Teil der Immuntherapie gelten als große Hoffnung gegen viele Erkrankungen wie Krebs.
Ein wichtiger Player im Bereich der mRNA-Impfstoffe ist BioNTech aus Mainz. Das Unternehmen war einer der wichtigen Impfstoff-entwickler zur Vorbeugung von Corona. Ursprünglich widmete sich BioNTech aber der Krebsbehandlung, der Corona-Impfstoff war hier nur so eine Art „Nebenerzeugnis“. Nun sind die Mainzer wieder zur Krebsbehandlung zurückgekehrt und wollen dabei unter anderem den Tübinger Konkurrenten CureVac übernehmen. Der Deal wird noch umgesetzt, das Management von CureVac unterstützt das Begehren.
Im Bereich der Immuntherapie hat auch Sanofi einen Deal getätigt und die US-Biopharma-Firma Blueprint Medicines gekauft. Durch die Übernahme bekommen die Franzosen Zugriff auf Avapritinib, das zur Behandlung von bestimmten Krebserkrankungen eingesetzt wird. Zudem verfügt Blueprint über eine interessante Pipeline an verschiedenen Immunologieprodukten.
Pluspunkte für „daheim“, zollfrei in die USA. Neben Immuntherapien standen im ersten Halbjahr auch Deals im Mittelpunkt, die auf die Behandlung von seltenen Erkrankungen abzielen. So übernahm Merck KgaA aus Darmstadt den US-Krebsspezialisten Springworks Therapeutics. Mit der Übernahme will Merck ein Geschäft rund um die Behandlung von seltenen Tumoren aufbauen. Springworks hat bereits ein in den USA zugelassenes Medikament zur Behandlung von fortschreitenden Weichteiltumoren sowie gegen eine Erkrankung mit gutartigen Tumoren auf der Haut.
Die Übernahme von Springworks könnte für Merck zudem den Nebeneffekt haben, dass sich im Falle einer Verabschiedung des europäischen „Pharma-Pakets“ quasi Pluspunkte für Merck in Sachen regulatorischer Datenschutz ergeben. Dieser kann verlängert werden, wenn ein Unternehmen bestimmte politische/gesellschaftliche Ziele einhält, etwa die Förderung der Erforschung von seltenen Krankheiten. Die „Pluspunkte“ könnten sich positiv auf andere Neuentwicklungen von Merck auswirken – als „Belohnung“ erhält das Unternehmen eine Verlängerung des Datenschutzes und ist damit vor Nachahmerpräparaten gefeit.
Und noch ein Punkt ist interessant. Es zeigt sich, dass europäische Pharmaunternehmen verstärkt in den USA auf Einkaufstour gehen. Das hat den Hintergrund, dass die US-Forschung erstklassig ist. Doch durch die Übernahmen in den USA könnte auch einem möglichen Zollstreit mit den USA vorgebeugt werden. Denn je präsenter ein europäisches Unternehmen in den USA mit Produktionsanlagen ist, desto wahrscheinlicher kann es mögliche Einfuhrzölle umgehen.
Wichtige rechtliche Hinweise – bitte lesen. Dieser Beitrag von BNP Paribas S.A. – Niederlassung Deutschland ist eine Produktinformation und Werbe- bzw. Marketingmitteilung, die sich an private und professionelle Kunden in Deutschland und Österreich richtet, wie definiert in § 67 deutsches Wertpapierhandelsgesetz (WpHG) und § 1 Z 35 und 36 österreichisches Wertpapieraufsichtsgesetz 2018 (WAG 2018). Er stellt weder ein Angebot noch eine Beratung, Empfehlung oder Aufforderung zum Kauf, Verkauf oder Halten irgendeiner Finanzanlage dar. Ferner handelt es sich nicht um eine Aufforderung, ein solches Angebot zu stellen. Insbesondere stellt dieser Beitrag keine Anlageberatung bzw. Anlageempfehlung dar, weil er die persönlichen Verhältnisse des jeweiligen Anlegers nicht berücksichtigt.
Es handelt sich um eine Werbe- bzw. Marketingmitteilung, die weder den gesetzlichen Anforderungen zur Gewährleistung der Unvoreingenommenheit bzw. der Förderung der Unabhängigkeit von Finanzanalysen noch dem Verbot des Handels im Anschluss an die Verbreitung von Finanzanalysen unterliegt. Der Erwerb von hierin beschriebenen Finanzinstrumenten bzw. Wertpapieren erfolgt ausschließlich auf Basis der im jeweiligen Prospekt nebst etwaigen Nachträgen und den endgültigen Angebotsbedingungen enthaltenen Informationen. Diese Dokumente können in elektronischer Form unter www.derivate.bnpparibas.com unter Eingabe der jeweiligen Wertpapierkennnummer (WKN oder ISIN) des Produkts bzw. der jeweilige Basisprospekt unter www.derivate.bnpparibas.com/service/basisprospekte abgerufen werden. Ebenso erhalten Sie diese Dokumente in deutscher oder englischer Sprache in elektronischer Form per Mail von derivate@bnpparibas.com bzw. in Papierform kostenfrei in Deutschland von BNP Paribas Emissions- und Handelsgesellschaft mbH Frankfurt am Main, Senckenberganlage 19, 60325 Frankfurt am Main.
Diese Werbe- bzw. Marketingmitteilung ersetzt keine persönliche Beratung. BNP Paribas S.A. rät dringend, vor jeder Anlageentscheidung eine persönliche Beratung in Anspruch zu nehmen. Um potenzielle Risiken und Chancen der Entscheidung, in das Wertpapier zu investieren, vollends zu verstehen wird ausdrücklich empfohlen, den jeweiligen Prospekt nebst etwaigen Nachträgen, die jeweiligen endgültigen Angebotsbedingungen sowie das jeweilige Basisinformationsblatt (KID) gut durchzulesen, bevor Anleger eine Anlageentscheidung treffen. BNP Paribas S.A (samt Zweigniederlassungen) ist kein Steuerberater und prüft nicht, ob eine Anlageentscheidung für den Kunden steuerlich günstig ist. Die steuerliche Behandlung hängt von den persönlichen Verhältnissen des Kunden ab und kann künftig Änderungen unterworfen sein. Kurse bzw. der Wert eines Finanzinstruments können steigen und fallen.
Basisinformationsblatt: Für die hierin beschriebenen Wertpapiere steht ein Basisinformationsblatt (KID) zur Verfügung. Dieses erhalten Sie in deutscher oder englischer Sprache kostenfrei in Deutschland von BNP Paribas Emissions- und Handelsgesellschaft mbH Frankfurt am Main, Senckenberganlage 19, 60325 Frankfurt am Main sowie unter www.derivate.bnpparibas.com unter Eingabe der Wertpapierkennnummer (WKN oder ISIN) des Wertpapiers.
Warnhinweis: Sie sind im Begriff, ein Produkt zu erwerben, das nicht einfach ist und schwer zu verstehen sein kann.
Hinweis auf bestehende Interessenkonflikte zu den besprochenen Wertpapieren/Basiswerten bzw. Produkten, die auf diesen Wertpapieren/Basiswerten basieren: Als Universalbank kann BNP Paribas S.A., ein mit ihr verbundenes Unternehmen oder eine andere Gesellschaft der BNP Paribas Gruppe mit Emittenten von in dem Beitrag genannten Wertpapieren/Basiswerten in einer umfassenden Geschäftsbeziehung stehen (zum Beispiel Dienstleistungen im Investmentbanking oder Kreditgeschäfte). Sie kann hierbei in Besitz von Erkenntnissen oder Informationen gelangen, die in dieser Werbe- bzw. Marketingmitteilung nicht berücksichtigt sind. BNP Paribas S.A., ein mit ihr verbundenes Unternehmen oder eine andere Gesellschaft der BNP Paribas Gruppe oder auch Kunden von BNP Paribas S.A. können auf eigene Rechnung Geschäfte in oder mit Bezug auf die in dieser Werbemitteilung angesprochenen Wertpapiere/Basiswerte getätigt haben oder als Marketmaker für diese agieren. Diese Geschäfte (zum Beispiel das Eingehen eigener Positionen in Form von Hedge-Geschäften) können sich nachteilig auf den Marktpreis, Kurs, Index oder andere Faktoren der jeweiligen genannten Produkte und damit auch auf den Wert der jeweiligen genannten Produkte auswirken. BNP Paribas S.A. unterhält interne organisatorische, administrative und regulative Vorkehrungen zur Prävention und Behandlung von Interessenkonflikten.
Wichtige Information für US-Personen: Die hierin beschriebenen Produkte und Leistungen sind nicht an US Personen gerichtet. Dieser Beitrag darf nicht in die USA eingeführt oder gesandt oder in den USA oder an US-Personen verteilt werden.
Emittentenrisiko: Die in diesem Beitrag beschriebenen Wertpapiere werden von BNP Paribas Emissions- und Handelsgesellschaft mbH Frankfurt am Main emittiert und von der BNP Paribas S.A. garantiert. Als Inhaberschuldverschreibungen unterliegen die von BNP Paribas Emissions- und Handelsgesellschaft mbH Frankfurt am Main emittierten und von der BNP Paribas S.A. garantierten Wertpapiere keiner Einlagensicherung. Der Anleger trägt daher mit Erwerb des Wertpapiers das Ausfallrisiko der Emittentin sowie der Garantin. Angaben zum maßgeblichen Rating von BNP Paribas S.A. sind unter www.derivate.bnpparibas.com erhältlich. Ein Totalverlust des vom Anleger eingesetzten Kapitals ist möglich.
Marken: DAX® und TecDAX® sind eingetragene Marken der Deutschen Börse AG. STOXXSM , STOXX 50SM und EURO STOXX 50SM Index sind Marken der STOXX Limited. STOXX Limited ist ein Unternehmen der Deutschen Börse. SMI® ist eine eingetragene Marke der SIX Swiss Exchange. ATX (Austrian Traded Index®) und RDX (Russian Depository Index®) werden durch die Wiener Börse AG real-time berechnet und veröffentlicht. WIG 20® ist eine eingetragene Marke der Warsaw Stock Exchange. BUX® ist eine eingetragene Marke der Budapest Stock Exchange. Dow Jones Industrial AverageSM ist ein Dienstleistungszeichen von McGraw-Hill Companies. S&P 500® ist ein eingetragenes Warenzeichen der McGraw-Hill Companies, Inc. Nasdaq 100® ist eine eingetragene Marke von The Nasdaq Stock Market, Inc. NYSE Arca Gold Bugs Index ist Eigentum der NYSE Euronext. Nikkei 225® Index ist Eigentum der Nihon Keizai Shimbun, Inc. TOPIX® ist Eigentum der Japan Exchange Group. Hang Seng IndexSM und Hang Seng China Enterprises IndexSM sind Eigentum von Hang Seng Indexes Company Limited. KOSPI 200SM ist Eigentum der Korea Stock Exchange. SET 50SM ist ein eingetragenes Warenzeichen der Stock Exchange of Thailand. MSCI® ist ein eingetragenes Warenzeichen von MSCI Inc. IBEX 35 ist ein eingetragenes Warenzeichen der Sociedad de Bolsas S.A. CECE EUR Index ® ist Eigentum und eingetragenes Warenzeichen der Wiener Börse AG. Der FTSE/ASE 20 Index® ist gemeinsames Eigentum der Athens Stock Exchange und von FTSE International Limited und wurde für den Gebrauch durch BNP Paribas S.A. – Niederlassung Deutschland lizenziert. FTSE International Limited fördert, unterstützt oder bewirbt nicht diese Produkte. FTSE™, FTSE® und Footsie® sind registrierte Marken der London Stock Exchange Plc und The Financial Times Limited und werden von FTSE International unter einer Lizenz verwendet. NIFTY 50SM ist ein eingetragenes Warenzeichen der National Stock Exchange of India. S&P Toronto Stock Exchange 60 Index® ist ein eingetragenes Warenzeichen der McGraw-Hill Companies Inc. Dow Jones Turkey Titans 20 Index ist eine Dienstleistungsmarke von Dow Jones & Company, Inc. und wurde für den Gebrauch durch BNP Paribas S.A. – Niederlassung Deutschland lizenziert. LPX 50® und LPX® Major Market Index sind eingetragene Marken der LPX GmbH, Basel. GPR 250 Global Index ist eingetragenes Warenzeichen von Global Property Research. MSCI® World Index und MSCI® Emerging Markets sind eingetragene Warenzeichen von MSCI Inc.
Das vorliegende Dokument wurde von der BNP Paribas S.A. Niederlassung Deutschland erstellt, eine Niederlassung der BNP Paribas S.A. mit Hauptsitz in Paris, Frankreich. BNP Paribas S.A. Niederlassung Deutschland, Senckenberganlage 19, 60325 Frankfurt am Main wird von der Europäischen Zentralbank (EZB) und der Autorité de Contrôle Prudentiel et de Résolution (ACPR) beaufsichtigt, ist von der Bundesanstalt für Finanzdienstleistungsaufsicht (BaFin) zugelassen und ist Gegenstand beschränkter Regulierung durch die BaFin. BNP Paribas S.A. ist von der EZB und der ACPR zugelassen und wird von der Autorité des Marchés Financiers in Frankreich beaufsichtigt. BNP Paribas S.A. ist als Gesellschaft mit beschränkter Haftung in Frankreich eingetragen. Sitz: 16 Boulevard des Italiens, 75009 Paris, France. www.bnpparibas.com.
© 2025 BNP Paribas. Alle Rechte vorbehalten. Wiedergabe oder Vervielfältigung des Inhalts dieses Beitrag oder von Teilen davon in jeglicher Form ohne unsere vorherige Einwilligung sind untersagt.


